পদার্থের গঠন (Structure of Matter) রসায়ন বিজ্ঞান ৩য় অধ্যায় এস এস সি 2026
আজকের বঙ্গে সবাইকে স্বাগতম! এই লেখায় ৯ম ও ১০ম শ্রেণির রসায়ন বিজ্ঞানের ৩য় অধ্যায়ের পদার্থের গঠন পূর্ণাঙ্গ সারসংক্ষেপ | পদার্থের গঠন রসায়নের একটি মৌলিক অধ্যায়, যেখানে পদার্থ কীভাবে মৌল, যৌগ, পরমাণু ও অণু দ্বারা গঠিত তা সহজভাবে ব্যাখ্যা করা হয়। রসায়ন বিজ্ঞানের ৩য় অধ্যায়ের (পার্ট ১) পদার্থের গঠন নিয়ে আমরা সম্পূর্ণ আলোচনা করেছি। আপনি এই নোট পড়লে আপনাকে গাইড কিনতে হবে না। আশা করি আপনাদের উপকারে আসবে।
আমাদের এই পেইজটি বুকমার্ক করে রাখতে পারেন। পরবর্তী অংশগুলো আপনারা এই সাইট থেকে পড়তে পারবেন। ৩য় অধ্যায়ের (পার্ট ২)
১. মৌলিক ও যৌগিক পদার্থ (Elements and Compounds)
পৃথিবীতে বিদ্যমান সব পদার্থ মূলত দুই প্রকার — মৌলিক পদার্থ ও যৌগিক পদার্থ।
(ক) মৌলিক পদার্থ
যে পদার্থকে রাসায়নিকভাবে ভেঙে আর সহজ পদার্থে বিভক্ত করা যায় না, তাকে মৌলিক পদার্থ বলে। যেমন— সোনা (Au), রূপা (Ag), লোহা (Fe), তামা (Cu) ইত্যাদি।
মৌলিক পদার্থের ক্ষুদ্রতম একক হলো পরমাণু (Atom)। এখন পর্যন্ত প্রায় ১১৮টি মৌল আবিষ্কৃত হয়েছে, যার মধ্যে কিছু প্রাকৃতিক ও কিছু কৃত্রিম।
নবম শ্রেণি বিজ্ঞান : ৯ম অধ্যায় (তড়িৎ প্রবাহ) সৃজনশীল প্রশ্ন ও উত্তর
(খ) যৌগিক পদার্থ
যখন দুটি বা ততোধিক মৌল নির্দিষ্ট অনুপাতে রাসায়নিকভাবে যুক্ত হয়, তখন একটি নতুন পদার্থ সৃষ্টি হয়, যাকে যৌগিক পদার্থ (Compound) বলে। যেমন— পানি (H₂O), সোডিয়াম ক্লোরাইড (NaCl), কার্বন ডাই-অক্সাইড (CO₂)।
যৌগিক পদার্থের বৈশিষ্ট্য তার উপাদান মৌলগুলোর বৈশিষ্ট্য থেকে সম্পূর্ণ ভিন্ন হয়।
২. পরমাণু ও অণু (Atoms and Molecules)
পরমাণু হলো মৌলিক পদার্থের ক্ষুদ্রতম কণা, যা এককভাবে মৌলের ধর্ম বজায় রাখে। পরমাণুগুলো একত্র হয়ে অণু তৈরি করে।
(ক) অণু (Molecule)
দুই বা ততোধিক পরমাণু একত্রে যুক্ত হয়ে যে ক্ষুদ্রতম কণাটি কোনো যৌগ বা মৌলের ধর্ম ধারণ করে, তাকে অণু বলে।
উদাহরণ —
অক্সিজেন গ্যাসের একটি অণু = O₂
হাইড্রোজেন গ্যাসের একটি অণু = H₂
পানির একটি অণু = H₂O
(খ) যৌগিক অণু ও মৌলিক অণু
মৌলিক অণু: একই মৌলের পরমাণু দ্বারা গঠিত (যেমন— O₂, N₂, H₂)।
যৌগিক অণু: ভিন্ন ভিন্ন মৌলের পরমাণু দ্বারা গঠিত (যেমন— H₂O, CO₂, NH₃)।
৩. মৌলের প্রতীক (Symbols of Elements)
প্রতিটি মৌলের একটি নির্দিষ্ট প্রতীক (Symbol) রয়েছে। সাধারণত ইংরেজি বা ল্যাটিন নামের প্রথম অক্ষর, অথবা প্রথম দুটি অক্ষর দ্বারা প্রতীক নির্ধারণ করা হয়।
(ক) ইংরেজি নাম অনুযায়ী প্রতীক
মৌল ইংরেজি নাম প্রতীক
হাইড্রোজেন Hydrogen H
অক্সিজেন Oxygen O
নাইট্রোজেন Nitrogen N
কার্বন Carbon C
ক্লোরিন Chlorine Cl
(খ) ল্যাটিন নাম অনুযায়ী প্রতীক
কিছু মৌলের প্রতীক ল্যাটিন নাম থেকে নেওয়া হয়েছে:
মৌল ল্যাটিন নাম প্রতীক
সোডিয়াম Natrium Na
পটাশিয়াম Kalium K
লোহা Ferrum Fe
রূপা Argentum Ag
সোনা Aurum Au
তামা Cuprum Cu
সিসা Plumbum Pb
পারদ Hydrargyrum Hg
নবম-দশম বিজ্ঞান ১০ম অধ্যায় সৃজনশীল প্রশ্ন ও উত্তর [Learn Science]
৪. সংকেত (Formula)
সংকেত হলো অণুর গঠন বোঝানোর পদ্ধতি। এটি দেখায়, কোনো অণুতে কতগুলো এবং কী ধরনের পরমাণু রয়েছে।
যেমন—
হাইড্রোজেন: H₂
অক্সিজেন: O₂
পানি: H₂O
অ্যামোনিয়া: NH₃
সালফিউরিক অ্যাসিড: H₂SO₄
হাইড্রোক্লোরিক অ্যাসিড: HCl
অণুর সংকেত দেখে বোঝা যায় পদার্থটির উপাদান মৌলগুলো এবং তাদের অনুপাত।
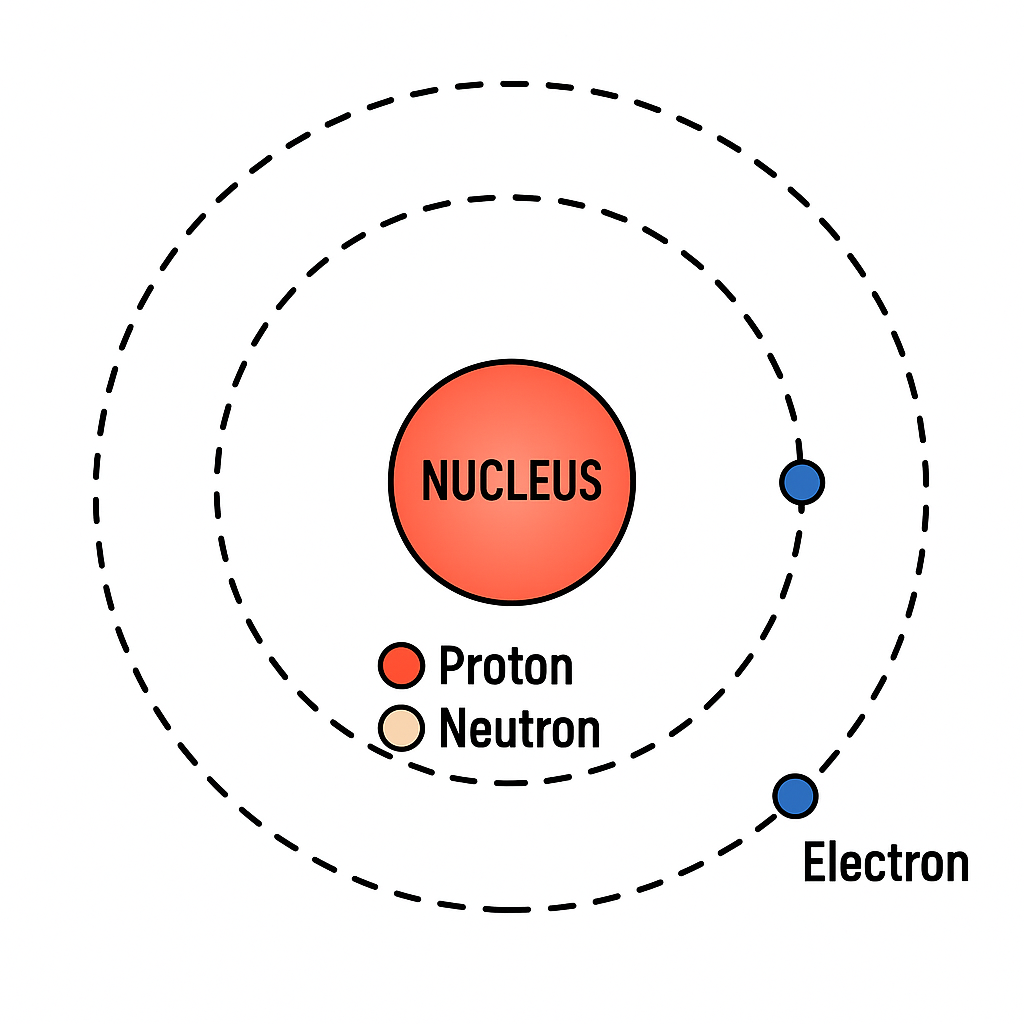
৫. পরমাণুর সংগঠন (The Fundamental Particles of an Atom)
পরমাণু মূলত তিনটি মৌলিক কণার সমন্বয়ে গঠিত:
- ইলেকট্রন (Electron)
- প্রোটন (Proton)
- নিউট্রন (Neutron)
(ক) ইলেকট্রন
ঋণাত্মক আধানযুক্ত মৌলিক কণা।
আধান = −1.60 × 10⁻¹⁹ কুলম্ব
ভর = 9.11 × 10⁻²⁸ গ্রাম
পরমাণুর কেন্দ্রের চারপাশে প্রদক্ষিণ করে।
(খ) প্রোটন
ধনাত্মক আধানযুক্ত কণা।
আধান = +1.60 × 10⁻¹⁹ কুলম্ব
ভর = 1.67 × 10⁻²⁴ গ্রাম
পরমাণুর কেন্দ্রে (নিউক্লিয়াসে) অবস্থান করে।
(গ) নিউট্রন
কোনো আধান নেই (নিরপেক্ষ কণা)।
ভর = 1.67 × 10⁻²⁴ গ্রাম (প্রায় প্রোটনের সমান)।
এটি নিউক্লিয়াসে অবস্থান করে এবং প্রোটনের সাথে মিলে পরমাণুর ভর নির্ধারণ করে।
সারসংক্ষেপ টেবিল (মৌলিক কণার গুণাবলি):
কণার নাম আধান ভর (গ্রাম) আপেক্ষিক আধান আপেক্ষিক ভর
ইলেকট্রন −1.60 × 10⁻¹⁹ 9.11 × 10⁻²⁸ −1 0
প্রোটন +1.60 × 10⁻¹⁹ 1.67 × 10⁻²⁴ +1 1
নিউট্রন 0 1.67 × 10⁻²⁴ 0 1

৬. পারমাণবিক সংখ্যা (Atomic Number, Z)
পরমাণুর কেন্দ্রস্থলে অবস্থিত প্রোটনের সংখ্যাকেই বলা হয় পারমাণবিক সংখ্যা।
একটি মৌলের প্রতিটি পরমাণুর পারমাণবিক সংখ্যা একই।
উদাহরণ —
হাইড্রোজেন (H) → Z = 1
হিলিয়াম (He) → Z = 2
সোডিয়াম (Na) → Z = 11
পারমাণবিক সংখ্যা = ইলেকট্রনের সংখ্যাও (কারণ নিরপেক্ষ পরমাণুতে প্রোটন = ইলেকট্রন)।
৭. ভর সংখ্যা (Mass Number, A)
কোনো পরমাণুর নিউক্লিয়াসে থাকা প্রোটন ও নিউট্রন সংখ্যার যোগফলকে বলা হয় ভর সংখ্যা।
👉 সূত্র:
A = (প্রোটন সংখ্যা) + (নিউট্রন সংখ্যা)
উদাহরণ: সোডিয়ামের (Na) জন্য
A = 23, Z = 11
নিউট্রন সংখ্যা = A − Z = 23 − 11 = 12
৮. মৌলের সংকীর্ণ প্রকাশ (Representation of an Atom)
কোনো মৌলকে সাধারণভাবে নিচেরভাবে প্রকাশ করা হয়—
^{A}_{Z}X
যেখানে,
X = মৌলের প্রতীক
A = ভর সংখ্যা
Z = পারমাণবিক সংখ্যা
উদাহরণ:
^{23}_{11}Na
৯. উদাহরণসহ ব্যাখ্যা
মৌলের প্রতীক পারমাণবিক সংখ্যা (Z) ভর সংখ্যা (A) ইলেকট্রন সংখ্যা নিউট্রন সংখ্যা (A−Z) সংকীর্ণ প্রকাশ
H 1 1 1 0 ¹₁H
He 2 4 2 2 ⁴₂He
১০. প্রয়োগভিত্তিক কাজ
ছাত্রছাত্রীদের জন্য উদাহরণস্বরূপ অনুশীলন:
ও মৌলের জন্য —
লিথিয়ামের ভর সংখ্যা ৭, প্রোটন সংখ্যা ৩ → নিউট্রন সংখ্যা = ৪।
বেরিলিয়ামের ভর সংখ্যা ৯, প্রোটন সংখ্যা ৪ → নিউট্রন সংখ্যা = ৫।
১১. গুরুত্বপূর্ণ তথ্যসংক্ষেপ
- মৌল → একই ধরনের পরমাণু দ্বারা গঠিত পদার্থ।
- যৌগ → ভিন্ন মৌলের পরমাণু দ্বারা গঠিত পদার্থ।
- পরমাণু → মৌলের ক্ষুদ্রতম একক।
- অণু → দুটি বা ততোধিক পরমাণুর সংযুক্ত রূপ।
- পারমাণবিক সংখ্যা (Z) → প্রোটনের সংখ্যা।
- ভর সংখ্যা (A) → প্রোটন ও নিউট্রনের যোগফল।
- নিউট্রন সংখ্যা = A − Z
- ইলেকট্রন সংখ্যা = Z (নিরপেক্ষ অবস্থায়)।
- ইলেকট্রন → ঋণাত্মক আধানযুক্ত; প্রোটন → ধনাত্মক; নিউট্রন → নিরপেক্ষ।
- একটি মৌলের প্রতীক নির্দিষ্ট ভাষা ও নিয়মে প্রকাশ করা হয়।
পদার্থের গঠন — ২০টি এমসিকিউ প্রশ্ন ও উত্তর
১. যে পদার্থকে রাসায়নিকভাবে আর সহজ পদার্থে বিভক্ত করা যায় না, তাকে কী বলে?
ক) যৌগ
খ) মৌল ✅
গ) মিশ্রণ
ঘ) দ্রবণ
২. পানির রাসায়নিক সংকেত কী?
ক) HO
খ) H₂O ✅
গ) H₂
ঘ) O₂
৩. পরমাণুর কেন্দ্রস্থলে কী থাকে?
ক) ইলেকট্রন
খ) প্রোটন ও নিউট্রন ✅
গ) কেবল ইলেকট্রন
ঘ) প্রোটন ও ইলেকট্রন
৪. প্রোটনের আধান কত?
ক) −1
খ) +1 ✅
গ) 0
ঘ) −2
৫. নিরপেক্ষ পরমাণুতে প্রোটন সংখ্যা ও ইলেকট্রন সংখ্যা
ক) অসমান
খ) সমান ✅
গ) দ্বিগুণ
ঘ) অর্ধেক
৬. অক্সিজেনের অণু সংকেত কী?
ক) O
খ) O₂ ✅
গ) O₃
ঘ) O₄
৭. ভর সংখ্যা (A) = ?
ক) প্রোটন + ইলেকট্রন
খ) প্রোটন + নিউট্রন ✅
গ) ইলেকট্রন + নিউট্রন
ঘ) কেবল প্রোটন
৮. ইলেকট্রনের আধান
ক) ধনাত্মক
খ) ঋণাত্মক ✅
গ) শূন্য
ঘ) পরিবর্তনশীল
৯. মৌলিক অণু কোনটি?
ক) CO₂
খ) H₂O
গ) O₂ ✅
ঘ) NH₃
১০. হিলিয়ামের পারমাণবিক সংখ্যা কত?
ক) ১
খ) ২ ✅
গ) ৩
ঘ) ৪
১১. NaCl কোন ধরনের পদার্থ?
ক) মৌল
খ) যৌগ ✅
গ) মিশ্রণ
ঘ) দ্রবণ
১২. প্রোটনের ভর প্রায় কত?
ক) 1.67 × 10⁻²⁴ গ্রাম ✅
খ) 9.11 × 10⁻²⁸ গ্রাম
গ) 1.60 × 10⁻¹⁹ গ্রাম
ঘ) 2.67 × 10⁻²⁰ গ্রাম
১৩. সোডিয়ামের প্রতীক কী?
ক) So
খ) S
গ) Na ✅
ঘ) Sd
১৪. পরমাণুর ক্ষুদ্রতম কণাটি কী নামে পরিচিত?
ক) অণু
খ) আয়ন
গ) পরমাণু ✅
ঘ) মৌল
১৫. যৌগিক অণুর উদাহরণ কোনটি?
ক) N₂
খ) H₂
গ) CO₂ ✅
ঘ) O₂
১৬. মৌলের প্রতীক সাধারণত কোন ভাষা থেকে নেওয়া হয়?
ক) গ্রিক ও ফরাসি
খ) ইংরেজি ও ল্যাটিন ✅
গ) সংস্কৃত ও ইংরেজি
ঘ) আরবি ও ল্যাটিন
১৭. নিউট্রনের আধান কত?
ক) ধনাত্মক
খ) ঋণাত্মক
গ) শূন্য ✅
ঘ) পরিবর্তনশীল
১৮. পারমাণবিক সংখ্যা দ্বারা কী বোঝায়?
ক) নিউট্রন সংখ্যা
খ) ইলেকট্রন সংখ্যা
গ) প্রোটন সংখ্যা ✅
ঘ) ভর সংখ্যা
১৯. পানি (H₂O) গঠিত হয়েছে
ক) ১টি হাইড্রোজেন ও ২টি অক্সিজেন
খ) ২টি হাইড্রোজেন ও ১টি অক্সিজেন ✅
গ) ২টি অক্সিজেন ও ২টি হাইড্রোজেন
ঘ) ১টি হাইড্রোজেন ও ১টি অক্সিজেন
২০. রাসায়নিক সংকেত দ্বারা বোঝানো হয়
ক) পদার্থের রং
খ) পদার্থের ভর
গ) পদার্থে কত ও কী ধরনের পরমাণু আছে ✅
ঘ) পদার্থের অবস্থা
পদার্থের গঠন — ১০টি সৃজনশীল প্রশ্ন ও উত্তর
১. প্রশ্ন:
হাইড্রোজেন গ্যাসের একটি অণুতে দুইটি হাইড্রোজেন পরমাণু থাকে। এ থেকে তুমি কী বুঝতে পারো?
উত্তর:
এটি প্রমাণ করে যে অণু একাধিক পরমাণু দ্বারা গঠিত। একই মৌলের পরমাণু একত্রে যুক্ত হয়ে মৌলিক অণু (H₂) তৈরি করে।
২. প্রশ্ন:
একটি পরমাণুর প্রোটন সংখ্যা ৮ ও নিউট্রন সংখ্যা ৮ হলে, এর পারমাণবিক সংখ্যা ও ভর সংখ্যা নির্ণয় করো।
উত্তর:
পারমাণবিক সংখ্যা (Z) = প্রোটন সংখ্যা = ৮
ভর সংখ্যা (A) = প্রোটন + নিউট্রন = ৮ + ৮ = ১৬
অতএব, পরমাণুটি হলো অক্সিজেন (¹⁶₈O)।
৩. প্রশ্ন:
যদি কোনো পরমাণুতে প্রোটন সংখ্যা ১১ এবং ইলেকট্রন সংখ্যা ১০ হয়, তবে পদার্থটির প্রকৃতি কী হবে?
উত্তর:
প্রোটনের চেয়ে ইলেকট্রন কম, তাই এটি ধনাত্মক আধানযুক্ত আয়ন (Na⁺)। অর্থাৎ এটি সোডিয়াম আয়ন।
৪. প্রশ্ন:
কেন যৌগিক পদার্থের বৈশিষ্ট্য তার উপাদান মৌলের বৈশিষ্ট্য থেকে ভিন্ন হয়?
উত্তর:
যখন মৌলগুলো রাসায়নিকভাবে যুক্ত হয়, তখন নতুন অণু তৈরি হয় যার ইলেকট্রন বিন্যাস সম্পূর্ণ ভিন্ন। ফলে যৌগের নতুন রাসায়নিক ধর্ম সৃষ্টি হয়, যা উপাদান মৌলগুলোর ধর্ম থেকে আলাদা।
৫. প্রশ্ন:
ইলেকট্রনের আধান ও ভরের মান এত ছোট কেন গুরুত্বপূর্ণ?
উত্তর:
কারণ ইলেকট্রনের ক্ষুদ্র ভর ও ঋণাত্মক আধানই রাসায়নিক বন্ধন, আয়ন গঠন ও পদার্থের বৈদ্যুতিক ধর্ম নির্ধারণ করে। ক্ষুদ্র হলেও এর ভূমিকা মৌলিক।
৬. প্রশ্ন:
পরমাণুর কেন্দ্রস্থলে কেবল প্রোটন ও নিউট্রনই কেন থাকে, ইলেকট্রন নয়?
উত্তর:
ইলেকট্রনের ভর খুবই কম এবং তারা শক্তির প্রভাবে কেন্দ্রের চারপাশে গতিশীল থাকে। প্রোটন ও নিউট্রন ভারী ও স্থিতিশীল হওয়ায় তারা নিউক্লিয়াসে অবস্থান করে।
৭. প্রশ্ন:
ভর সংখ্যা ২৩ এবং পারমাণবিক সংখ্যা ১১ — পদার্থটি কী? নিউট্রন সংখ্যা নির্ণয় করো।
উত্তর:
এটি সোডিয়াম (Na)।
নিউট্রন সংখ্যা = A − Z = ২৩ − ১১ = ১২
অতএব, সোডিয়ামের নিউট্রন সংখ্যা ১২।
৮. প্রশ্ন:
কেন বলা হয়, “পরমাণু হলো মৌলের ক্ষুদ্রতম একক”?
উত্তর:
কারণ কোনো মৌলের রাসায়নিক ধর্ম একমাত্র তার পরমাণুর গঠন দ্বারা নির্ধারিত হয়, এবং পরমাণু ভেঙে ফেললে মৌলিক ধর্ম হারিয়ে যায়।
৯. প্রশ্ন:
একটি যৌগে হাইড্রোজেন ও অক্সিজেন ২:১ অনুপাতে যুক্ত থাকে। এটি কোন যৌগ এবং এর গঠন ব্যাখ্যা করো।
উত্তর:
এটি পানি (H₂O)। দুটি হাইড্রোজেন পরমাণু একটি অক্সিজেন পরমাণুর সঙ্গে যুক্ত হয়ে একক অণু গঠন করে, যা তরল অবস্থায় বিদ্যমান এবং মৌলগুলোর ধর্ম থেকে সম্পূর্ণ ভিন্ন।
১০. প্রশ্ন:
যদি কোনো মৌলের প্রতীক ²³₁₁Na হয়, এর থেকে কী কী তথ্য পাওয়া যায়?
উত্তর:
মৌলের নাম: সোডিয়াম
পারমাণবিক সংখ্যা (Z) = ১১
ভর সংখ্যা (A) = ২৩
প্রোটন সংখ্যা = ১১
নিউট্রন সংখ্যা = ২৩ − ১১ = ১২
ইলেকট্রন সংখ্যা = ১১ (নিরপেক্ষ অবস্থায়)
পদার্থের গঠন — ১০টি সাধারণ প্রশ্নোত্তর (FAQ)
১. প্রশ্ন: পদার্থ বলতে কী বোঝায়?
উত্তর: যে বস্তুর ভর আছে এবং স্থান দখল করে, তাকে পদার্থ বলে। যেমন— পানি, বায়ু, লোহা, কাঠ ইত্যাদি।
২. প্রশ্ন: মৌল কী?
উত্তর: যে পদার্থ রাসায়নিকভাবে ভেঙে আরও সহজ পদার্থে বিভক্ত করা যায় না, তাকে মৌল বলে। যেমন— সোনা (Au), হাইড্রোজেন (H), অক্সিজেন (O)।
৩. প্রশ্ন: যৌগ কী?
উত্তর: দুটি বা ততোধিক মৌল নির্দিষ্ট অনুপাতে রাসায়নিকভাবে যুক্ত হয়ে যে নতুন পদার্থ তৈরি করে, তাকে যৌগ বলে। যেমন— পানি (H₂O), NaCl, CO₂।
৪. প্রশ্ন: পরমাণু কী?
উত্তর: কোনো মৌলের ক্ষুদ্রতম কণা, যা ঐ মৌলের ধর্ম বজায় রাখে, তাকে পরমাণু বলে।
৫. প্রশ্ন: অণু কী?
উত্তর: দুটি বা ততোধিক পরমাণু যুক্ত হয়ে যে ক্ষুদ্রতম কণাটি কোনো পদার্থের ধর্ম বজায় রাখে, তাকে অণু বলে। যেমন— H₂, O₂, H₂O।
৬. প্রশ্ন: পারমাণবিক সংখ্যা (Z) কী?
উত্তর: কোনো পরমাণুর নিউক্লিয়াসে প্রোটনের সংখ্যাকেই পারমাণবিক সংখ্যা বলে। এটি মৌলকে সনাক্ত করতে সাহায্য করে।
৭. প্রশ্ন: ভর সংখ্যা (A) কী?
উত্তর: পরমাণুর নিউক্লিয়াসে প্রোটন ও নিউট্রন সংখ্যার যোগফলই ভর সংখ্যা। সূত্র: A = প্রোটন + নিউট্রন।
৮. প্রশ্ন: ইলেকট্রন, প্রোটন ও নিউট্রনের আধান কী রকম?
উত্তর:
ইলেকট্রন → ঋণাত্মক আধান
প্রোটন → ধনাত্মক আধান
নিউট্রন → নিরপেক্ষ (কোনো আধান নেই)
৯. প্রশ্ন: নিউট্রন সংখ্যা কীভাবে নির্ণয় করা হয়?
উত্তর: নিউট্রন সংখ্যা = ভর সংখ্যা − পারমাণবিক সংখ্যা (N = A − Z)।
১০. প্রশ্ন: কেন “পদার্থের গঠন” অধ্যায়টি রসায়নের ভিত্তি বলে ধরা হয়?
উত্তর: কারণ পদার্থের সব রাসায়নিক ধর্ম, বিক্রিয়া ও যৌগ গঠন পরমাণুর গঠন ও উপাদান কণার বিন্যাসের ওপর নির্ভর করে।
উপসংহার
পদার্থের গঠন বিষয়ে ধারণা রসায়নের মূলভিত্তি। প্রতিটি পদার্থের বৈশিষ্ট্য নির্ভর করে তার মৌল, অণু, এবং পরমাণুর গঠন ও বিন্যাসের ওপর। পরমাণুর মধ্যে ইলেকট্রন, প্রোটন ও নিউট্রনের বিন্যাসের পার্থক্যই মৌলিক বৈচিত্র্যের সৃষ্টি করে।
এই মৌলিক ধারণাগুলিই পরবর্তীতে রাসায়নিক বিক্রিয়া, যৌগ গঠন, এবং পদার্থের ভৌত-রাসায়নিক ধর্ম ব্যাখ্যা করতে সাহায্য করে।